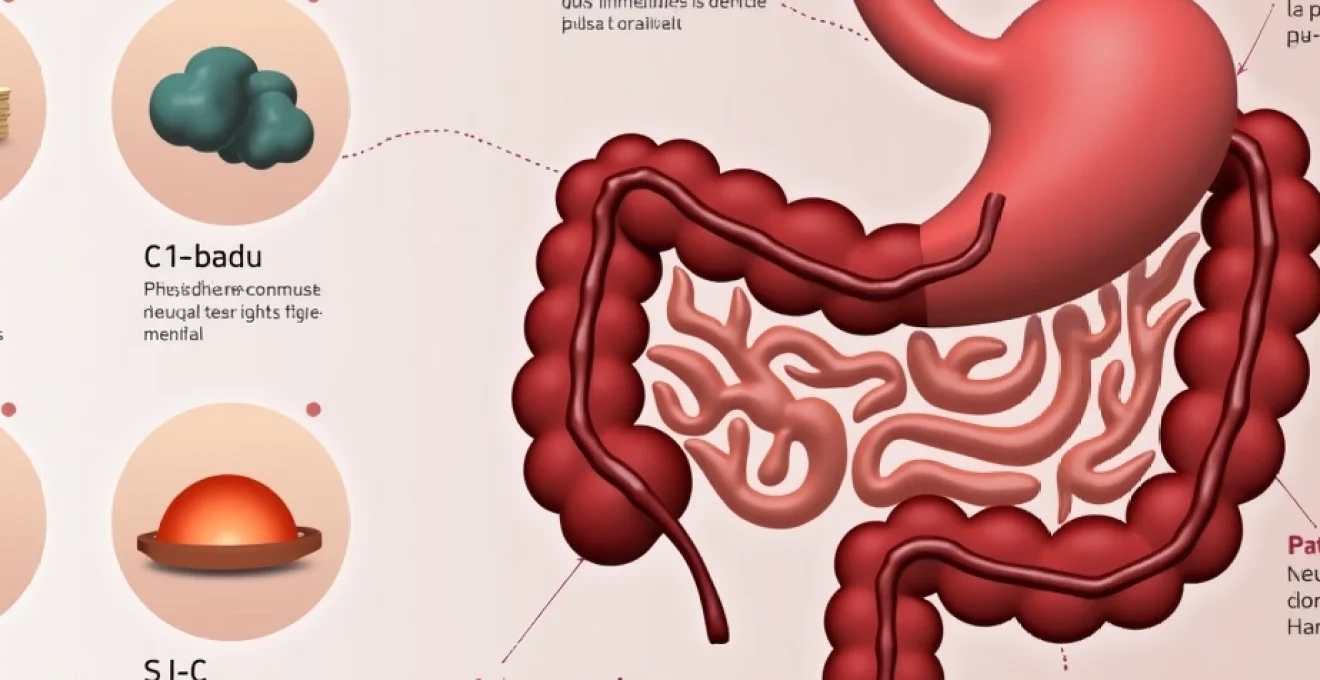
Le syndrome de l’intestin irritable (SII) représente l’un des troubles digestifs fonctionnels les plus fréquents, touchant entre 10 à 15% de la population mondiale selon les dernières études épidémiologiques. Cette pathologie chronique, caractérisée par une constellation de symptômes gastro-intestinaux récurrents, constitue aujourd’hui un véritable défi diagnostique et thérapeutique pour les professionnels de santé. Bien que considéré comme bénin sur le plan pronostique, le SII génère un impact considérable sur la qualité de vie des patients et représente un coût socio-économique majeur pour les systèmes de santé. La compréhension approfondie de ses mécanismes physiopathologiques complexes ouvre désormais la voie vers des approches thérapeutiques plus ciblées et personnalisées.
Critères diagnostiques du syndrome de l’intestin irritable selon rome IV
Symptômes cardinaux : douleurs abdominales et troubles du transit
Les critères de Rome IV, établis en 2016 par un consensus international d’experts, définissent le syndrome de l’intestin irritable comme une pathologie caractérisée par des douleurs abdominales récurrentes associées à des modifications du transit intestinal. Ces douleurs, véritables marqueurs pathognomoniques de la maladie, doivent présenter au moins deux des caractéristiques suivantes : une amélioration lors de la défécation, une association avec des changements de fréquence des selles, ou une corrélation avec des modifications de la consistance fécale.
La topographie douloureuse reste variable, pouvant siéger dans différentes régions abdominales : péri-ombilicale, hypogastrique, ou suivant le trajet colique. L’intensité des symptômes fluctue considérablement d’un patient à l’autre, oscillant entre de simples gênes digestives et des douleurs invalidantes nécessitant un arrêt de travail. Cette variabilité phénotypique constitue l’un des défis majeurs pour le diagnostic précoce et la prise en charge optimale.
Fréquence et durée minimales des manifestations cliniques
Pour répondre aux critères diagnostiques actuels, les symptômes doivent être présents au moins un jour par semaine au cours des trois derniers mois, avec un début remontant à au moins six mois avant le diagnostic. Cette exigence temporelle permet de distinguer le SII des épisodes aigus de gastro-entérite ou des troubles digestifs transitoires liés au stress. La chronicité représente donc un élément fondamental du diagnostic différentiel.
L’évolution clinique se caractérise typiquement par une alternance de phases symptomatiques et de périodes de rémission relative. Ces fluctuations, souvent imprévisibles, compliquent l’évaluation thérapeutique et nécessitent un suivi longitudinal attentif. L’absence de symptômes nocturnes constitue généralement un élément rassurant, distinguant le SII des pathologies organiques inflammatoires.
Critères d’exclusion des pathologies organiques inflammatoires
Le diagnostic de SII impose l’exclusion formelle de toute pathologie organique sous-jacente susceptible d’expliquer la symptomatologie. Les signaux d’alarme suivants doivent conduire à des investigations complémentaires approfondies : présence de sang dans les selles, perte de poids inexpliquée, anémie ferriprive, fièvre persistante, ou début des symptômes après 50 ans. Ces éléments orientent vers des pathologies inflammatoires chroniques intestinales (MICI) ou néoplasiques.
L’examen biologique initial doit comprendre une numération formule sanguine, un bilan inflammatoire (CRP, VS), et un dosage des anticorps anti-transglutaminases pour dépister une maladie cœliaque. La calprotectine fécale, biomarqueur inflammatoire spécifique, présente une excellente valeur prédictive négative pour exclure une MICI chez les patients de moins de 45 ans sans signaux d’alarme.
Classification phénotypique : SII-D, SII-C et SII-M selon bristol
L’échelle de Bristol, référentiel international pour l’évaluation de la consistance fécale, permet de classifier le SII en trois sous-types distincts selon le trouble du transit prédominant. Le SII avec constipation (SII-C) se caractérise par des selles de type 1-2 de Bristol dans plus de 25% des défécations, tandis que le SII avec diarrhée (SII-D) présente des selles de type 6-7 dans la même proportion. Le SII mixte (SII-M) combine les deux phénotypes de manière alternante.
Cette classification phénotypique revêt une importance capitale pour l’orientation thérapeutique, chaque sous-type nécessitant des approches spécifiques adaptées aux mécanismes physiopathologiques sous-jacents.
La détermination précise du sous-type exige une évaluation sur au moins deux semaines consécutives, en dehors de tout traitement modificateur du transit. Cette caractérisation influence directement le choix des modalités thérapeutiques, notamment la sélection des probiotiques spécifiques et des modulateurs de la motricité intestinale.
Physiopathologie complexe des troubles de l’axe intestin-cerveau
Dysfonction de la motricité gastro-intestinale et hypersensibilité viscérale
La physiopathologie du SII implique des altérations complexes de la motricité gastro-intestinale, se manifestant par des anomalies du complexe moteur migrant et des contractions coliques. Ces dysfonctions se traduisent cliniquement par une accélération du transit dans les formes diarrhéiques ou un ralentissement dans les formes constipées. L’hypersensibilité viscérale, mécanisme central de la genèse douloureuse, résulte d’une sensibilisation des voies nociceptives entériques et centrales.
Les études manométriques révèlent des anomalies de la coordination motrice entre les différents segments intestinaux, perturbant l’efficacité de la progression du contenu digestif. Cette dyscoordination explique la sensation de vidange incomplète fréquemment rapportée par les patients. L’hypersensibilité viscérale se caractérise par un abaissement du seuil douloureux lors de la distension rectale ou colique, phénomène objectivable par barostat.
Perturbations du microbiote intestinal et dysbiose fonctionnelle
Le microbiote intestinal des patients souffrant de SII présente des altérations qualitatives et quantitatives significatives par rapport aux sujets sains. Cette dysbiose fonctionnelle se caractérise par une diminution de la diversité microbienne globale, une réduction des bactéries productrices de butyrate (Faecalibacterium prausnitzii, Roseburia), et une augmentation relative des entérobactéries potentiellement pathogènes.
Les conséquences métaboliques de cette dysbiose incluent une modification du profil des acides gras à chaîne courte, une altération du métabolisme des acides biliaires, et une perturbation de la production de neurotransmetteurs entériques. Ces modifications contribuent directement à l’entretien des symptômes through des mécanismes inflammatoires et de perméabilité intestinale. La restauration d’un microbiote équilibré constitue donc un objectif thérapeutique prioritaire.
Activation de l’axe hypothalamo-hypophyso-surrénalien
L’axe intestin-cerveau joue un rôle prépondérant dans la physiopathologie du SII, impliquant des interactions bidirectionnelles complexes entre le système nerveux central et le système nerveux entérique. Le stress psychologique active l’axe hypothalamo-hypophyso-surrénalien, entraînant une libération de cortisol et de catécholamines qui modifient directement la motricité et la perméabilité intestinales.
Cette activation neuro-endocrinienne explique la corrélation clinique observée entre les épisodes de stress et les exacerbations symptomatiques. Les patients présentent souvent des antécédents de traumatismes psychiques ou de troubles anxio-dépressifs, renforçant l’importance d’une approche thérapeutique intégrative. La modulation de cette réponse au stress constitue un levier thérapeutique essentiel dans la prise en charge globale.
Inflammation de bas grade et perméabilité intestinale accrue
Bien que le SII soit classiquement considéré comme non inflammatoire, des études récentes révèlent l’existence d’une inflammation de bas grade caractérisée par une augmentation modérée des cytokines pro-inflammatoires (IL-1β, TNF-α, IL-6) et une activation des mastocytes de la muqueuse intestinale. Cette inflammation sub-clinique contribue à l’hypersensibilité viscérale et aux troubles de la motricité observés.
L’augmentation de la perméabilité intestinale, mise en évidence chez environ 50% des patients, permet le passage paracellulaire de macromolécules et d’antigènes bactériens, entretenant l’activation immunitaire locale. Cette altération de la fonction barrière résulte de modifications des jonctions serrées et de la diminution de l’expression des protéines claudine et occludine. La restauration de l’intégrité épithéliale représente un objectif thérapeutique émergent.
Dysrégulation des neurotransmetteurs entériques sérotonine et GABA
Le système nerveux entérique produit plus de 90% de la sérotonine de l’organisme, neurotransmetteur majeur de la régulation motrice et sensitive intestinale. Les patients SII présentent fréquemment des anomalies du métabolisme sérotoninergique, avec des variations des taux plasmatiques et urinaires de sérotonine selon le sous-type clinique. Ces perturbations influencent directement la motricité colique et la perception douloureuse viscérale.
Le GABA (acide gamma-aminobutyrique), principal neurotransmetteur inhibiteur du système nerveux, joue également un rôle crucial dans la modulation de la sensibilité viscérale. Sa dysrégulation contribue à l’hyperalgie viscérale caractéristique du SII. La compréhension de ces mécanismes neurochimiques ouvre des perspectives thérapeutiques ciblées, notamment through l’utilisation de modulateurs sérotoninergiques spécifiques.
Stratégies thérapeutiques ciblées selon les sous-types cliniques
Modulateurs de la motricité : lopéramide, linaclotide et plécanatide
Le lopéramide, agoniste des récepteurs μ-opioïdes périphériques, constitue le traitement de première intention du SII-D par son action ralentissante sur le transit colique. Sa faible pénétration de la barrière hémato-encéphalique limite les effets centraux indésirables tout en préservant l’efficacité périphérique. La posologie recommandée varie de 2 à 12 mg par jour, adaptée selon la réponse clinique et la tolérance.
Pour le SII-C, les agonistes de la guanylyl cyclase C (linaclotide, plécanatide) représentent une innovation thérapeutique majeure. Ces molécules augmentent la sécrétion chlorée et hydrique intestinale tout en exerçant des effets antinociceptifs directs. Le linaclotide (290 μg/jour) et le plécanatide (3 mg/jour) ont démontré leur efficacité dans des essais randomisés contrôlés, avec une amélioration significative des douleurs abdominales et de la constipation. Leur mécanisme d’action dual justifie leur positionnement privilégié dans l’arsenal thérapeutique du SII-C.
Probiotiques spécifiques : bifidobacterium infantis et lactobacillus plantarum
La supplémentation probiotique ciblée constitue une approche thérapeutique rationnelle basée sur la correction de la dysbiose intestinale. Bifidobacterium infantis 35624, à la dose de 10^8 UFC par jour, a démontré son efficacité dans la réduction globale des symptômes du SII, particulièrement les ballonnements et les douleurs abdominales. Cette souche spécifique exerce des effets anti-inflammatoires et immunomodulateurs documentés.
Lactobacillus plantarum 299v présente une efficacité particulière dans le SII-D, avec une amélioration significative de la fréquence et de la consistance des selles. Sa capacité de colonisation temporaire du tractus gastro-intestinal et sa production d’acides organiques contribuent à la restauration de l’équilibre microbien. La durée optimale de supplémentation varie de 4 à 12 semaines selon les études cliniques, avec des effets persistants plusieurs semaines après l’arrêt.
Antispasmodiques musculotropes : mébévérine et trimébutine
Les antispasmodiques musculotropes représentent un pilier thérapeutique historique du SII, particulièrement efficaces sur les douleurs abdominales spastiques. La mébévérine (135-200 mg trois fois par jour) exerce une action relaxante directe sur les fibres musculaires lisses intestinales sans effet anticholinergique systémique, préservant ainsi la motricité physiologique.
La trimébutine (200 mg trois fois par jour) présente un profil pharmacologique unique, combinant des effets agonistes et antagonistes selon l’état fonctionnel du muscle lisse intestinal, permettant une normalisation de la motricité plutôt qu’une simple inhibition.
Ces molécules démontrent une excellente tolérance avec un profil d’effets indésirables minimal, justifiant leur utilisation prolongée si nécessaire. Leur efficacité optimale s’observe lors de la prise avant les repas, anticipant les contractions post-prandiales responsables des douleurs abdominales.
Régime d’éviction FODMAP et réintroduction progressive
Le régime pauvre en FODMAP (Fermentable Oligosaccharides, Disaccharides, Monosaccharides And Polyols) constitue une approche nutritionnelle validée pour la prise en charge du SII. Cette stratégie thérapeutique repose sur la restriction temporaire d’hydrates de carbone fermentescibles responsables de la production excessive de gaz intestinaux et de l
‘osmolarité et la distension intestinales. La phase d’éviction, d’une durée de 2 à 6 semaines, doit être menée sous supervision diététique pour prévenir les carences nutritionnelles et assurer l’observance optimale.
La phase de réintroduction progressive constitue l’étape cruciale permettant d’identifier les catégories de FODMAP spécifiquement mal tolérées par chaque patient. Cette personnalisation alimentaire améliore l’adhésion thérapeutique à long terme et évite les restrictions excessives. Les études cliniques démontrent une efficacité de 70% sur l’amélioration globale des symptômes, particulièrement marquée sur les ballonnements et les douleurs abdominales.
Biomarqueurs émergents et outils diagnostiques innovants
L’évolution des techniques de biologie moléculaire ouvre des perspectives diagnostiques prometteuses pour le SII. L’analyse du métabolome fécal révèle des signatures métaboliques spécifiques, notamment des altérations du profil des acides gras à chaîne courte et des métabolites bactériens. Ces empreintes moléculaires pourraient permettre un diagnostic précoce et une stratification des patients selon leur profil métabolique.
Les biomarqueurs sérologiques émergents incluent les anticorps anti-flagelline et anti-CdtB, témoins d’une infection gastro-intestinale antérieure potentiellement déclenchante du SII post-infectieux. La zonuline sérique, marqueur de perméabilité intestinale, présente des taux élevés chez 40% des patients SII et pourrait guider les thérapies ciblant l’intégrité épithéliale. L’intégration de ces biomarqueurs dans des algorithmes diagnostiques pourrait révolutionner l’approche clinique du SII.
Les technologies d’imagerie fonctionnelle, notamment l’IRM fonctionnelle et la tomographie par émission de positons, permettent désormais l’exploration non invasive de l’axe intestin-cerveau. Ces outils révèlent des patterns d’activation cérébrale spécifiques lors de la stimulation viscérale, objectivant les mécanismes de sensibilisation centrale. Comment ces avancées technologiques transformeront-elles notre compréhension et notre prise en charge du SII dans les prochaines décennies ?
Approches intégratives et médecine personnalisée du SII
La médecine personnalisée du SII repose sur l’intégration de multiples paramètres : profil génétique, composition du microbiote, signatures métaboliques et facteurs psychosociaux. Les polymorphismes génétiques des récepteurs sérotoninergiques (HTR3 et HTR4) influencent la réponse aux thérapeutiques ciblant ces voies, ouvrant la voie à une pharmacogénomique du SII. Cette approche permettrait d’optimiser le choix thérapeutique dès la première prescription.
L’intelligence artificielle et les algorithmes d’apprentissage automatique révolutionnent l’analyse des données complexes du SII. Ces outils permettent d’identifier des sous-groupes de patients présentant des profils de réponse thérapeutique similaires, facilitant la personnalisation des traitements. L’intégration des données cliniques, biologiques et des questionnaires de qualité de vie dans des modèles prédictifs améliore significativement les résultats thérapeutiques.
L’approche intégrative combine harmonieusement les thérapeutiques conventionnelles et les médecines complémentaires, créant un écosystème thérapeutique adapté à chaque patient.
Les thérapies comportementales et cognitives, l’hypnothérapie médicale et les techniques de mindfulness démontrent une efficacité clinique substantielle dans la prise en charge du SII. Ces approches modulent l’axe intestin-cerveau par des mécanismes neuroplastiques, réduisant l’hypersensibilité viscérale et améliorant la qualité de vie. La télémédecine et les applications mobiles de santé facilitent l’accès à ces thérapies et permettent un suivi personnalisé en temps réel.
La nutrition fonctionnelle personnalisée, basée sur l’analyse du microbiote individuel et des intolérances alimentaires spécifiques, représente l’avenir de la prise en charge nutritionnelle du SII. Cette approche sur mesure, comparable à un costume parfaitement ajusté, optimise les bénéfices thérapeutiques tout en préservant le plaisir alimentaire et la socialisation. L’évolution vers une médecine de précision transformera-t-elle fondamentalement notre approche de cette pathologie complexe qu’est le syndrome de l’intestin irritable ?
L’avenir du traitement du SII réside dans cette convergence entre innovation technologique et approche humaniste, plaçant le patient au centre d’un écosystème thérapeutique personnalisé et évolutif. Cette révolution médicale promet d’améliorer significativement le pronostic fonctionnel et la qualité de vie des millions de patients souffrant de cette pathologie chronique.