Le glaucome représente aujourd’hui la deuxième cause de cécité dans le monde et affecte plus d’un million de personnes en France. Cette neuropathie optique progressive se caractérise par une dégénérescence irréversible des fibres du nerf optique, entraînant une altération du champ visuel qui peut évoluer vers la cécité en l’absence de traitement approprié. L’enjeu majeur réside dans le diagnostic précoce et la mise en place d’une stratégie thérapeutique adaptée pour préserver la fonction visuelle. Les avancées récentes en ophtalmologie offrent désormais un éventail de solutions thérapeutiques permettant de ralentir significativement la progression de cette maladie silencieuse.
Mécanismes physiopathologiques du glaucome et progression de la neuropathie optique
Élévation de la pression intraoculaire et altération du drainage de l’humeur aqueuse
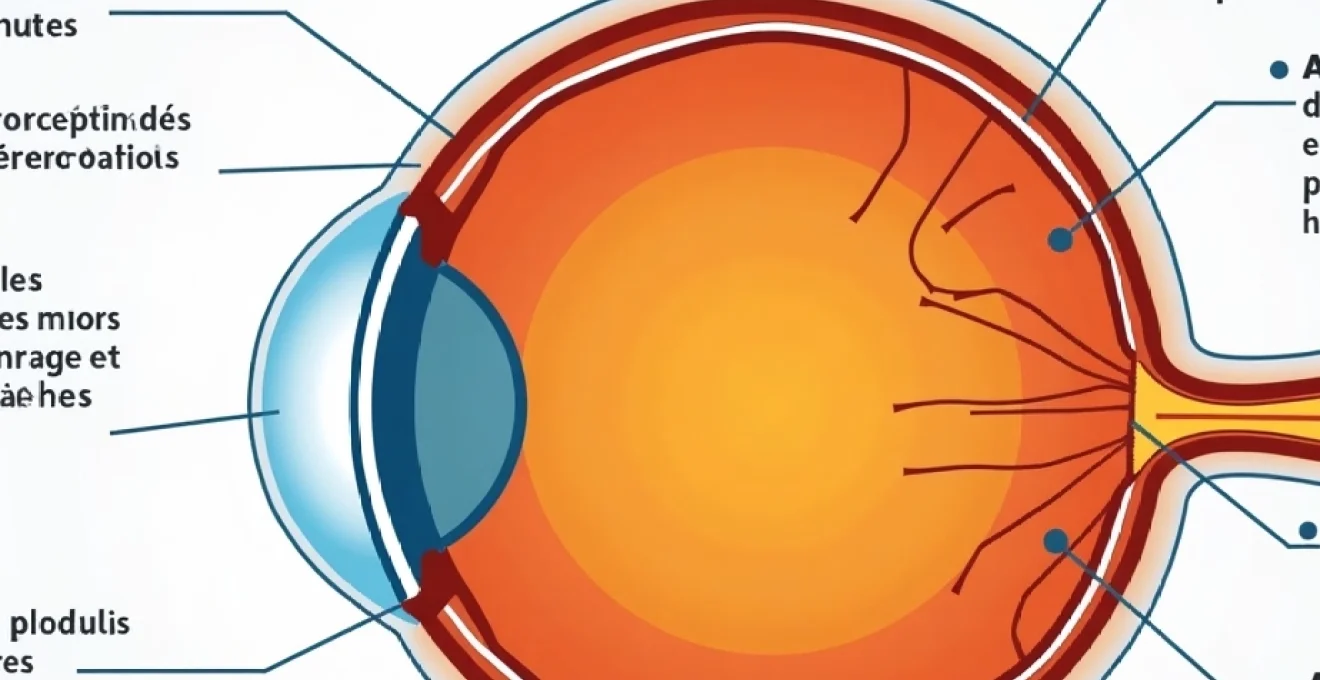
La compréhension des mécanismes physiopathologiques du glaucome constitue le fondement de toute approche thérapeutique efficace. L’ hypertension intraoculaire demeure le principal facteur de risque modifiable, résultant d’un déséquilibre entre la production et l’évacuation de l’humeur aqueuse. Cette substance transparente, produite par les procès ciliaires, circule normalement de la chambre postérieure vers la chambre antérieure de l’œil, avant d’être évacuée par le trabéculum.
Dans le glaucome primitif à angle ouvert, le trabéculum subit des modifications structurelles progressives qui réduisent sa perméabilité. Ces altérations incluent l’accumulation de matériel extracellulaire, la dégénérescence des cellules trabéculaires et la modification de l’architecture des espaces intercellulaires. Lorsque la résistance à l’écoulement augmente, la pression intraoculaire s’élève au-delà des valeurs normales, généralement comprises entre 10 et 21 mmHg.
Dégénérescence des cellules ganglionnaires rétiniennes et excavation papillaire
L’élévation chronique de la pression intraoculaire exerce une contrainte mécanique sur les fibres du nerf optique au niveau de la lame criblée sclérale. Cette zone anatomiquement fragile constitue le point de passage des axones des cellules ganglionnaires rétiniennes vers le nerf optique. La compression progressive de ces fibres nerveuses entraîne une ischémie locale et déclenche des cascades de mort cellulaire programmée.
L’excavation papillaire, caractéristique morphologique du glaucome, résulte de la perte progressive des fibres nerveuses et du remodelage du tissu conjonctif de soutien. Cette excavation se mesure par le rapport cup/disc, qui augmente progressivement avec l’évolution de la maladie. Les fibres les plus vulnérables sont celles de grand calibre, responsables de la vision périphérique, expliquant pourquoi les déficits du champ visuel apparaissent initialement en périphérie.
Facteurs de risque vasculaires et ischémie du nerf optique
Au-delà de l’hypertension intraoculaire, des facteurs vasculaires contribuent significativement à la pathogenèse du glaucome. La perfusion insuffisante de la tête du nerf optique peut résulter d’une diminution de la pression de perfusion oculaire, calculée comme la différence entre la pression artérielle et la pression intraoculaire. Les patients présentant une hypotension artérielle nocturne excessive ou un syndrome d’apnée du sommeil montrent un risque accru de progression glaucomateuse.
La dysfonction endothéliale et les troubles de l’autorégulation vasculaire rétinienne jouent également un rôle important. Ces mécanismes expliquent pourquoi certains patients développent une neuropathie optique glaucomateuse malgré des pressions intraoculaires normales, soulignant la complexité multifactorielle de cette pathologie.
Glaucome à pression normale et mécanismes non-tensionnels
Le glaucome à pression normale, représentant environ 30% des glaucomes primitifs à angle ouvert, illustre l’importance des facteurs non-tensionnels dans la pathogenèse. Ces patients présentent une susceptibilité particulière du nerf optique aux pressions intraoculaires considérées comme normales. Les mécanismes impliqués incluent une compliance sclérale réduite, des propriétés biomécaniques cornéennes particulières, et une vulnérabilité génétique des cellules ganglionnaires rétiniennes.
L’épaisseur cornéenne centrale influence significativement la mesure de la pression intraoculaire par tonométrie de Goldmann. Les cornées fines conduisent à une sous-estimation de la pression réelle, tandis que les cornées épaisses la surestiment. Cette correction biomécanique s’avère cruciale pour évaluer le risque glaucomateux réel et adapter la stratégie thérapeutique.
Traitements médicamenteux topiques pour la réduction de la pression intraoculaire
Analogues des prostaglandines : latanoprost, bimatoprost et travoprost
Les analogues des prostaglandines constituent actuellement le traitement de première intention du glaucome chronique à angle ouvert. Ces molécules, administrées en instillation unique quotidienne le soir, agissent principalement en augmentant l’évacuation de l’humeur aqueuse par la voie uvéosclérale. Le latanoprost, premier représentant de cette classe, permet une réduction tensionnelle de 25 à 32% par rapport aux valeurs initiales.
Le bimatoprost et le travoprost offrent une efficacité comparable, avec des profils d’effets secondaires légèrement différents. Les effets indésirables les plus fréquents incluent l’hyperémie conjonctivale, l’hyperpigmentation périorbitaire, l’allongement des cils et, plus préoccupant, la modification permanente de la couleur de l’iris chez les patients aux yeux clairs. Ces effets cosmétiques, bien que généralement bénins, peuvent affecter l’observance thérapeutique.
Inhibiteurs de l’anhydrase carbonique : dorzolamide et brinzolamide
Les inhibiteurs de l’anhydrase carbonique topiques constituent une alternative importante, particulièrement en association avec d’autres classes thérapeutiques. Le dorzolamide et le brinzolamide réduisent la production d’humeur aqueuse en inhibant l’enzyme anhydrase carbonique au niveau des procès ciliaires. Cette inhibition diminue la formation d’ions bicarbonates, réduisant ainsi le transport actif de sodium et d’eau.
L’efficacité hypotensive de ces molécules atteint 15 à 20% de réduction tensionnelle. Le brinzolamide présente une meilleure tolérance locale que le dorzolamide, avec moins d’irritation oculaire et de sensation de picotement à l’instillation. Ces médicaments sont particulièrement utiles chez les patients présentant des contre-indications aux bêta-bloquants systémiques.
Bêta-bloquants : timolol et bétaxolol en première intention
Longtemps considérés comme le traitement de référence, les bêta-bloquants conservent une place importante dans l’arsenal thérapeutique glaucomateux. Le timolol, bêta-bloquant non sélectif, et le bétaxolol, bêta-1 sélectif, réduisent la production d’humeur aqueuse en bloquant les récepteurs adrénergiques des procès ciliaires. Leur efficacité hypotensive atteint 20 à 25% de réduction tensionnelle avec une administration bi-quotidienne.
La principale limitation de cette classe thérapeutique réside dans ses contre-indications systémiques. L’asthme, la bronchopneumopathie chronique obstructive, les troubles de conduction cardiaque et l’insuffisance cardiaque constituent des contre-indications absolues ou relatives. Le passage systémique, bien que limité, peut provoquer des effets indésirables cardiovasculaires et respiratoires, nécessitant une évaluation clinique préalable.
Agonistes alpha-2 adrénergiques : brimonidine et apraclonidine
La brimonidine représente l’agoniste alpha-2 adrénergique de référence, offrant un double mécanisme d’action : diminution de la production d’humeur aqueuse et augmentation de son évacuation uvéosclérale. Cette molécule présente également des propriétés neuroprotectrices démontrées expérimentalement, bien que leur pertinence clinique reste à confirmer chez l’homme.
L’efficacité hypotensive de la brimonidine atteint 15 à 20% de réduction tensionnelle. Ses principaux effets indésirables incluent la sécheresse oculaire, les réactions allergiques locales et, occasionnellement, la somnolence due au passage systémique. L’apraclonidine, moins utilisée en traitement chronique, trouve son indication principale dans la prévention des pics hypertensifs post-laser.
Associations fixes et optimisation de l’observance thérapeutique
Les associations fixes combinent deux principes actifs en un seul collyre, améliorant significativement l’observance thérapeutique. Les combinaisons les plus utilisées associent un analogue des prostaglandines à un bêta-bloquant, un inhibiteur de l’anhydrase carbonique ou un agoniste alpha-2. Ces préparations réduisent le nombre d’instillations quotidiennes et minimisent l’exposition aux conservateurs.
L’optimisation de l’observance constitue un enjeu majeur, car près de 40% des patients ne suivent pas correctement leur traitement. L’utilisation de flacons sans conservateur, l’éducation thérapeutique et les dispositifs d’aide à l’instillation contribuent à améliorer l’adhésion au traitement. L’observance thérapeutique représente un facteur pronostique crucial pour la préservation de la fonction visuelle à long terme.
L’efficacité des traitements médicamenteux dépend autant de leur puissance hypotensive que de la régularité de leur administration, soulignant l’importance capitale de l’éducation thérapeutique du patient.
Techniques de trabéculoplastie laser sélective et cyclophotocoagulation
La trabéculoplastie sélective au laser (SLT) représente une avancée majeure dans le traitement du glaucome, offrant une alternative non invasive aux traitements médicamenteux. Cette technique utilise un laser Nd:YAG doublé de fréquence, émettant à 532 nm, pour stimuler sélectivement les cellules pigmentées du trabéculum sans créer de dommages thermiques collatéraux. Le principe repose sur la phagocytose sélective des cellules trabéculaires pigmentées, déclenchant une cascade de cytokines qui améliore la perméabilité trabéculaire.
L’efficacité de la SLT se manifeste par une réduction tensionnelle de 20 à 30% chez environ 75% des patients traités. Cette efficacité se maintient généralement pendant 2 à 5 ans, avec possibilité de répéter la procédure en cas de perte d’efficacité. La SLT présente l’avantage de pouvoir être utilisée en première intention, particulièrement chez les patients présentant des difficultés d’observance thérapeutique ou des intolérances médicamenteuses.
La procédure se réalise en ambulatoire, sans anesthésie autre qu’une instillation de collyre anesthésiant. Les complications sont rares et incluent principalement une hypertonie transitoire post-laser et une inflammation intra-oculaire modérée. Le traitement anti-inflammatoire post-opératoire limite ces réactions et optimise les résultats. Les contre-indications restent limitées aux formes inflammatoires de glaucome et aux angles très étroits.
La cyclophotocoagulation, technique plus invasive, trouve son indication dans les glaucomes réfractaires ou en échec thérapeutique. Cette procédure utilise un laser diode trans-scléral pour détruire partiellement les procès ciliaires, réduisant ainsi la production d’humeur aqueuse. Bien qu’efficace, cette technique présente un risque plus élevé de complications, incluant l’hypotonie, l’inflammation chronique et la baisse d’acuité visuelle, limitant ses indications aux cas les plus sévères.
Chirurgies filtrantes : trabéculectomie et implants de drainage
Trabéculectomie avec mitomycine C et surveillance post-opératoire
La trabéculectomie demeure l’intervention de référence en chirurgie filtrante du glaucome, créant une voie de drainage artificielle pour l’humeur aqueuse vers l’espace sous-conjonctival. Cette technique, développée dans les années 1960, consiste à réaliser un volet scléral partiel permettant l’écoulement contrôlé de l’humeur aqueuse. L’utilisation d’agents antiprolifératifs comme la mitomycine C améliore significativement les résultats en réduisant la cicatrisation post-opératoire.
Le taux de succès de la trabéculectomie atteint 80 à 90% à un an, avec maintien de l’efficacité chez 70 à 80% des patients à cinq ans. L’objectif tensionnel visé dépend du stade évolutif du glaucome et de la vitesse de progression antérieure. Pour les glaucomes avancés, une pression intraoculaire inférieure à 12 mmHg s’avère souvent nécessaire pour prévenir la progression.
La surveillance post-opératoire revêt une importance capitale, nécessitant des contrôles rapprochés durant les premières semaines. Les complications précoces incluent l’hypotonie, l’effusion supraciliaire, et l’inflammation excessive. Les complications tardives comprennent l’encapsulement de la bulle de filtration, l’infection chronique, et la cataracte induite. La gestion appropriée de ces complications conditionne le succès à long terme de l’intervention.
Implants de ahmed, baerveldt et tubes de drainage glaucomateux
Les implants de drainage représentent une alternative importante à la trabéculectom
ie, particulièrement dans les glaucomes réfractaires ou en échec de trabéculectomie. L’implant d’Ahmed incorpore un mécanisme valvulaire bidirectionnel qui prévient l’hypotonie post-opératoire en maintenant une résistance minimale à l’écoulement. Cette valve s’ouvre lorsque la pression intraoculaire dépasse 8-10 mmHg, permettant un drainage contrôlé de l’humeur aqueuse vers un réservoir externe placé dans l’espace sous-conjonctival.
L’implant de Baerveldt, dépourvu de valve, offre une surface de filtration plus importante (250 à 350 mm²) comparativement à l’Ahmed (184 mm²). Cette caractéristique confère une efficacité hypotensive supérieure à long terme, mais nécessite une occlusion temporaire du tube par un fil de suture résorbable pour prévenir l’hypotonie précoce. La résorption progressive de cette suture permet un drainage différé après 4 à 6 semaines post-opératoires.
Les résultats à long terme montrent un taux de succès de 70 à 85% à cinq ans pour ces dispositifs de drainage. Les complications incluent l’érosion du tube, l’encapsulement du plateau, les troubles motilités oculaires et les infections. La sélection appropriée des patients et la technique chirurgicale rigoureuse conditionnent le succès de ces interventions complexes.
Sclérectomie profonde non perforante et viscocanalostomie
La sclérectomie profonde non perforante représente une alternative moins invasive à la trabéculectomie, préservant l’intégrité de la chambre antérieure. Cette technique consiste à créer un volet scléral superficiel, puis à exciser une portion de sclère profonde en respectant la membrane de Descemet. L’absence de perforation complète réduit significativement les risques d’hypotonie et d’infection post-opératoire.
La viscocanalostomie, variante de cette technique, associe l’injection d’acide hyaluronique dans le canal de Schlemm pour dilater les voies de drainage naturelles. Cette approche préserve l’anatomie physiologique tout en améliorant la perméabilité trabéculaire. L’efficacité hypotensive atteint 60 à 70% de réduction tensionnelle, avec un profil de sécurité supérieur aux techniques perforantes.
Ces procédures trouvent leurs meilleures indications chez les patients jeunes, les myopes forts et les cas nécessitant une intervention bilatérale. La courbe d’apprentissage plus longue et les résultats tensionnels parfois insuffisants dans les glaucomes avancés limitent leur adoption généralisée. L’association d’implants de collagène ou d’acide hyaluronique peut améliorer les résultats en maintenant l’espace de filtration.
Dispositifs MIGS : istent, hydrus et micro-invasive glaucoma surgery
La chirurgie micro-invasive du glaucome (MIGS) révolutionne l’approche thérapeutique en proposant des interventions moins traumatisantes avec récupération accélérée. L’iStent, premier dispositif de cette catégorie approuvé, consiste en un micro-tube en titane de 1 mm inséré dans le trabéculum pour créer un drainage direct vers le canal de Schlemm. Cette approche ab interno préserve la conjonctive pour d’éventuelles chirurgies ultérieures.
Le dispositif Hydrus étend ce concept avec un échafaudage courbe de 8 mm qui dilate et maintient ouvert une portion significative du canal de Schlemm. Cette conception améliore la perméabilité sur une circonférence plus étendue, optimisant théoriquement l’efficacité par rapport aux dispositifs ponctuels. Les études cliniques démontrent une réduction tensionnelle de 15 à 25% avec amélioration de l’observance médicamenteuse.
D’autres dispositifs MIGS incluent le Xen gel stent, implant de gélatine de porc créant un drainage trans-scléral, et les systèmes CyPass (retiré du marché) et Kahook Dual Blade pour la goniotomie ab interno. Ces innovations offrent des options thérapeutiques intermédiaires entre traitement médical et chirurgie conventionnelle, particulièrement adaptées aux glaucomes débutants à modérés.
Neuroprotection rétinienne et thérapies émergentes
Au-delà de la réduction de la pression intraoculaire, les stratégies de neuroprotection visent à préserver directement les cellules ganglionnaires rétiniennes contre les mécanismes de mort cellulaire. Les recherches actuelles explorent des voies thérapeutiques innovantes incluant les facteurs neurotrophiques, les inhibiteurs d’apoptose et les modulateurs du métabolisme mitochondrial. La neuroprotection pharmacologique pourrait révolutionner la prise en charge du glaucome, particulièrement dans les formes à pression normale.
Les facteurs de croissance nerveuse, notamment le BDNF (Brain-Derived Neurotrophic Factor) et le CNTF (Ciliary Neurotrophic Factor), montrent des résultats prometteurs dans les modèles expérimentaux. Ces molécules stimulent la survie neuronale et favorisent la régénération axonale. Les défis incluent leur stabilité, leur pénétration oculaire et leurs modes d’administration, avec exploration de systèmes de libération prolongée par implants biodégradables.
L’approche thérapeutique génique ouvre également des perspectives innovantes. Les vecteurs viraux adéno-associés (AAV) permettent l’expression locale de facteurs neuroprotecteurs ou d’enzymes antioxydantes. Ces stratégies visent à renforcer les mécanismes de défense cellulaire endogènes et à prévenir la cascade de mort neuronale caractéristique du glaucome.
Les thérapies par cellules souches représentent l’horizon le plus ambitieux, avec l’objectif de régénérer les cellules ganglionnaires perdues. Bien que les résultats précliniques soient encourageants, les défis techniques et éthiques maintiennent ces approches au stade de recherche fondamentale. La transplantation de cellules souches pluripotentes induites (iPSCs) différenciées en cellules rétiniennes constitue une piste particulièrement prometteuse.
Les thérapies neuroprotectrices représentent l’avenir du traitement glaucomateux, offrant l’espoir de préserver la vision même en l’absence de contrôle tensionnel parfait.
Surveillance ophtalmologique et critères d’évaluation de l’efficacité thérapeutique
La surveillance du glaucome nécessite une approche multimodale combinant évaluation morphologique et fonctionnelle pour détecter précocement toute progression. Le rythme de surveillance varie selon le stade évolutif, la vitesse de progression antérieure et l’efficacité du traitement en cours. Pour les glaucomes débutants stabilisés, des contrôles semestriels suffisent, tandis que les formes évoluées ou instables nécessitent une surveillance trimestrielle, voire mensuelle.
L’imagerie par tomographie en cohérence optique (OCT) révolutionne le suivi en quantifiant précisément l’épaisseur des fibres nerveuses péripapillaires et des cellules ganglionnaires maculaires. Cette technologie détecte des modifications structurelles avant l’apparition de déficits du champ visuel, permettant une intervention thérapeutique précoce. Les algorithmes de progression intégrés facilitent l’interprétation des changements subtils au cours du temps.
L’évaluation du champ visuel par périmétrie automatisée demeure l’examen de référence pour quantifier le retentissement fonctionnel. Les stratégies d’examen incluent la périmétrie statique standard (24-2 ou 30-2), la périmétrie SITA (Swedish Interactive Threshold Algorithm) et les techniques de périmétrie à fréquence doublée pour la détection précoce. L’analyse de la vitesse de progression exprimée en dB/an guide les décisions thérapeutiques.
Les critères d’efficacité thérapeutique englobent la stabilisation ou l’amélioration de la pression intraoculaire, l’absence de progression morphologique et fonctionnelle, et la préservation de la qualité de vie. L’évaluation de la qualité de vie liée à la vision utilise des questionnaires validés comme le VFQ-25 (Visual Function Questionnaire) ou le GQL-15 (Glaucoma Quality of Life). Ces outils mesurent l’impact réel de la maladie sur les activités quotidiennes du patient.
La définition d’une pression intraoculaire cible individualisée constitue un élément clé de la surveillance. Cette pression cible, généralement 20 à 30% inférieure aux valeurs pré-thérapeutiques, peut nécessiter des ajustements selon l’évolution clinique. Les patients présentant une progression malgré un contrôle tensionnel apparemment satisfaisant bénéficient d’une réduction plus agressive de leur pression intraoculaire ou de l’exploration de facteurs de risque additionnels.
L’adhésion thérapeutique, évaluée par questionnaire ou monitoring électronique, influence directement le pronostic. Les nouvelles technologies incluent les flacons connectés permettant un suivi en temps réel de l’observance. Cette surveillance objective aide à distinguer l’échec thérapeutique réel de la mauvaise observance, orientant ainsi les décisions d’escalade thérapeutique vers le laser ou la chirurgie.